欧州(EU)での医薬品の承認制度
医薬品の承認は、ほとんどの国において、それぞれの国の保健担当の規制当局(日本でいうと厚生労働省とPMDA)が、製薬企業からの医薬品としての承認申請に対して評価をおこない、医薬品として認めることができる品質、有効性、安全性があると認められた場合、正式に医薬品として利用できることになっています。
欧州においても、各国に医薬品を承認審査する規制当局があるのですが、欧州連合(EU)の加盟国では、それぞれの国での審査をせず、EUとして審査をすることで、そこで承認されればEU域内全ての国で承認するという制度を運用しています。
このようにEUとして審査をすることにより、各国がそれぞれに同じ医薬品を評価をする必要がなくなり各国の負担も軽減されるとともに、製薬企業にとっても、一か所に申請し承認が得られれば、欧州域内全域で一気に販売が可能になるというメリットがあります。
この「中央審査方式」という方法による申請をすれば、EUだけでなく、アイスランド、リヒテンシュタイン、ノルウェーを含めた欧州経済領域(EEA)の全域で有効な承認を得たことになり、販売できるようになります。
このEUの医薬品評価をおこなう行政組織がEuropean Medical Agency(EMA)です。
そのため、欧州(EU)で承認されている薬剤を調べようとすると、EMAのウェブサイトを調べることになります。
なお、EMAは、Brexitまではイギリス・ロンドンに所在していたのですが、Brexitによりオランダ・アムステルダムに移転しました。
EU単位でのEMAによる中央審査方式ではなく、例えばスペインやドイツといった加盟国の1国単位での承認を取ることも可能であり、近年でも少数ながらそのような形で承認を得ている薬もゼロではありません。そのような薬は、EMAのウェブサイトから調べることができません。
EMAのウェブサイトにおける医薬品の検索画面
EMAのウェブサイトは以下になります。
https://www.ema.europa.eu/en
それでは医薬品の検索をしてみましょう。
上部の青い部分にある「Medicines」をクリックするとメニューが広がりますので、その中にある「Search」を押下します。

以下のような画面になります。縦に長い画面になるので画像が切れていますが、左側に検索のためのメニューが並んでいます。
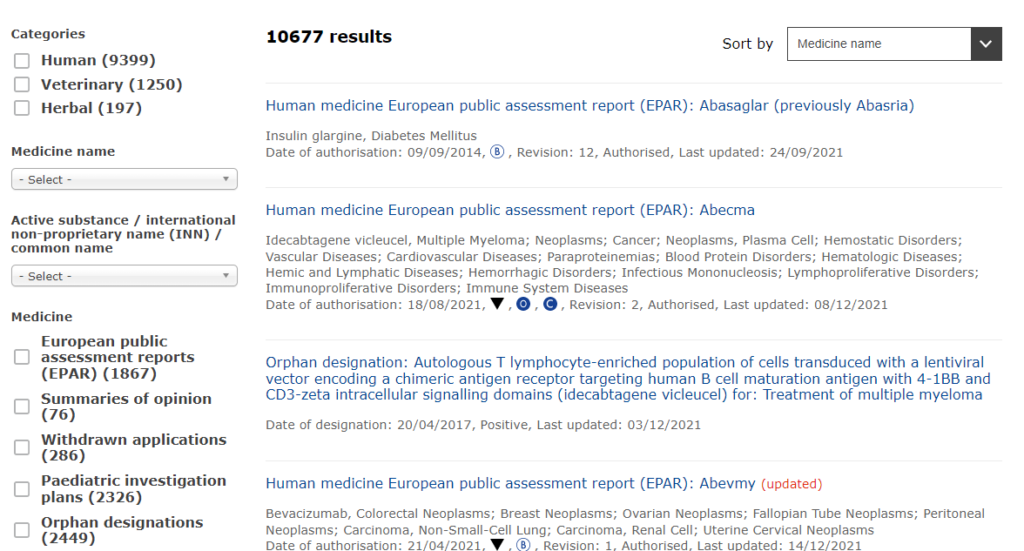
左のメニューの一番上に、「Categories」とあり、その中に3つのカテゴリーが並んでいます。
上から、ヒト、動物、生薬となっております。これは、EMAが人間用の西洋品だけでなく、動物薬や生薬の管理もおこなっているためです。
その下に、「Medicine name」という欄があります。基本はここに検索したい薬剤の商品名を入力します。
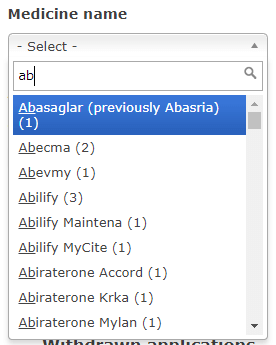
その下にも似たようなプルダウンの画面がありますが、こちらは「Active substance / international non-proprietary name (INN) / common name」となっている通り、成分名(一般名)で検索する場合に用います。
それより下にもいくつかメニューが並んでいますが、基本的には、これより下のメニューを使うことはないと思います。
検索してみる
では、日本でもCOVID-19の治療薬として有名になったレムデシビル(remdesivir)を例に検索してみます。
「remdesivir」は成分名なので、先ほどのメニューにあった「Active substance / international non-proprietary name (INN) / common name」に「remdesivir」を入力し、候補として現れる選択肢から「remdesivir」を選択します。

その結果、二つの検索結果が出てきました。
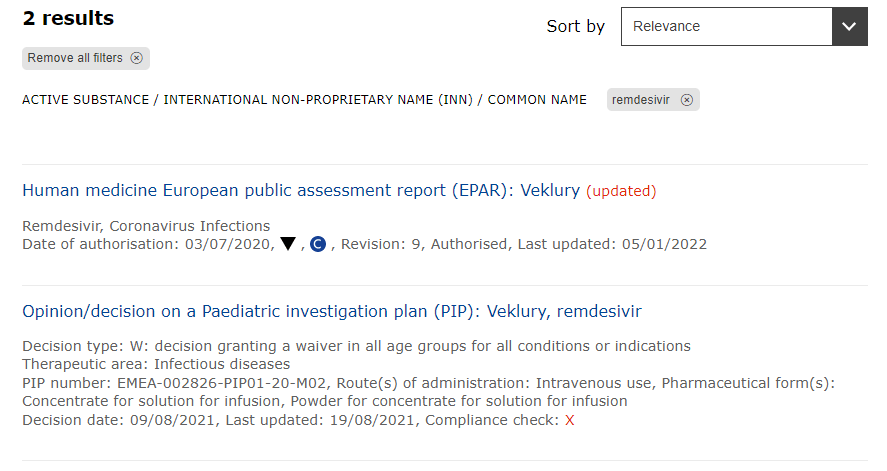
EPAR(European Public Assessment Report)は、EMAによる公表用の評価レポートです。目的によって、いくつか種類があるのですが、各薬剤の情報を得るには、EPARを選択しましょう。
検索して現れた一番上の「Human medicine European public assessment report (EPAR): Veklury (updated)」を押下します。
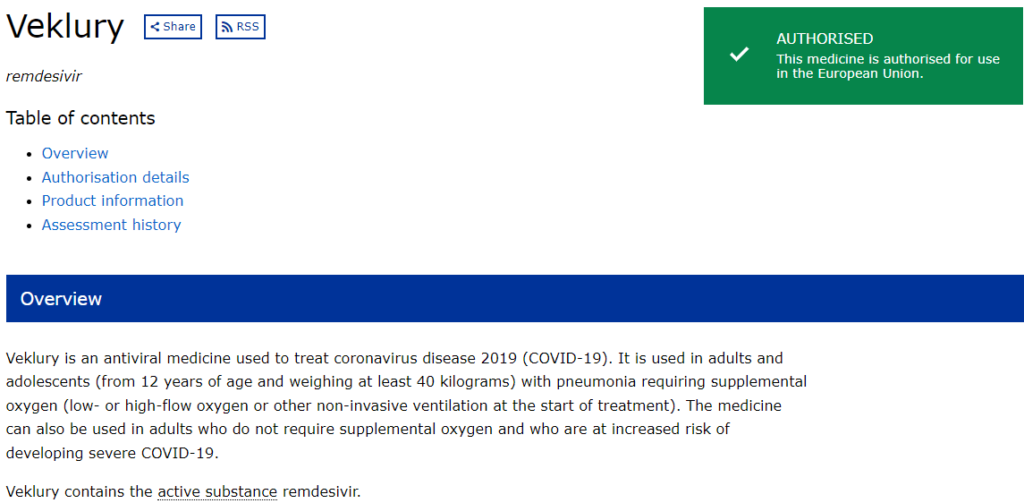
すると、上のような画面が出てきます。
このページから、レムデシビル(商品名:Veklury)の情報を閲覧することができます。
まず、「Overview」にて、この薬剤の簡単な要約を読むことができます。
その下には、8つのアコーディオンメニューがありますが、これがEPAR(Medicine overview)の中身です。

このアコーディオンメニューの下に、「EPAR-Medicine overview」のPDFがあると思いますが、そのファイルを開いて頂くと、このアコーディオンメニューの内容と一致していることが分かると思います。
それより下以降は、一般の人が閲覧するニーズはあまりないと思いますが、「Authorisation details」という承認時に付与された番号や薬剤カテゴリーなどの情報があります。
さらに下の方に行くと、「Product information」という場所に、「EPAR-Product information」というPDFがあります。
これは、以下の構成となっているのですが、日本の添付文書ぐらいの情報量のある文書(Summary of product characterstics)から、患者さん向けの説明文書(Package leaflet)も含まれています。
- Annex I – Summary of product characteristics
- Annex IIA – Manufacturing-authorisation holder responsible for batch release
- Annex IIB – Conditions of the marketing authorisation
- Annex IIIA – Labelling
- Annex IIIB – Package leaflet
承認時の、さらに専門的で詳細な情報を知りたい場合は、さらに下にある「Assessment history」の中にある各種文書を閲覧できます。
例えば、「Initial marketing-authorisation documents」の「Veklury : EPAR – Public assessment report」を見ていただくと、非臨床から臨床、PK/PD、ベネフィット・リスクバランスなどの多岐にわたった情報を得ることができます。




