2023年4月24日にアメリカのInstitute for Clinical and Economic Review (ICER)、カナダのCanadian Agency for Drugs and Technologies in Health (CADTH)、イギリスのNational Institute for Health and Care Excellence (NICE)という世界的にもトップクラスの医療技術評価(HTA:Health Technology Assessment)の機関が共同でポジション・ステートメントを公表しました。

そのタイトルは「Position statement: Confidentiality of clinical evidence informing health technology assessment decision making」(医療技術評価の意思決定に資する臨床エビデンスの機密性)というものです。
医療技術評価では、エビデンスと意思決定の透明性を確保することと、機密情報を保護することとの間で重要なバランスを取る必要がありますが、このバランスについての考え方を示したものとなっています。
製薬企業においては、HTA Dossierの内容・書きっぷりについて検討する必要が出てくるかもしれません。
今回は、この共同のポジション・ステートメントの内容を見ていきます。

このポジション・ステートメントにおける「Redaction」という英語には「編集」という訳を当てはめていますが、実際には「(削除を目的とした)編集」という意味です。
そのため「編集」を「削除」と読み替えてもらっても良いかと思います。
(「redact」「recactable」も「編集する」「編集可能」といった訳にしていますが、実質的には「削除する」「削除可能」と読み替え可能)
我々は誰なのか?
- CADTHは、カナダの医薬品・医療技術機関である。カナダの連邦政府、州政府、準州政府から資金援助を受けている非営利団体で、カナダの公的資金による医療システムで使用される医薬品、機器、サービスに関する独立した情報と助言を提供している。
- 2006年に設立され、2013年に非営利法人化されたInstitute for Clinical and Economic Review(ICER)は、米国における医療の価値に関する客観的な証拠を提供する、公平で独立した信頼できる情報機関である。
- National Institute for Health and Care Excellence (NICE)は、イングランドのNHSとソーシャルケアにおいて、個人と社会全体のために最高のケアと費用対効果を両立させることを目的としている。
我々は何をするのか?
- CADTH、ICER、NICEは、医薬品やその他の医療技術について独立した評価を行っている。医療政策や診療の意思決定者は、医薬品、機器、医療機器、歯科機器、外科機器の適切な使用や処置・手術のための財源に関連して、それらへのアクセスに関する意思決定に我々の評価を利用している。我々の評価は一般に公開されている。
- 我々の機関は、異なる医療制度で活動し、独自の方法と手順を持っている。しかしながら、我々は概ね同様の目的を有し、我々の活動は医療技術評価に関する共通の価値観に支えられている(医療技術評価の新しい定義を参照)。
我々は、意思決定の中心にエビデンスを据えるという努力の中で、透明性を最大限に高めることを目指している。我々は、患者やその家族、臨床医、そしてすべての利害関係者に対して、希少な医療資源の配分に関する選択を行う際に考慮したエビデンスについて明らかにし、情報を提供する義務がある。 - このような共通点を踏まえ、我々は、我々の機関に影響を与える共通の問題に対する解決策を見出すために協力したいと考えている。臨床エビデンスの機密性に関するこのポジションステートメントは、このような協力関係の第一弾となるものである。
HTAの新しい定義
HTAの定義は以下の通りであり、重要な明確化情報は4つの付属の注釈で提供されている。
HTAは、医療技術のライフサイクルの様々な時点における価値を、明確な手法を用いて決定する学際的なプロセスである。その目的は、公平で効率的かつ質の高い医療システムを促進するために、意思決定に情報を提供することである。注1:医療技術とは、病状の予防、診断、治療、健康増進、リハビリテーションの提供、または医療提供の組織化のために開発された介入を指す。介入は、試験、装置、医薬品、ワクチン、手順、プログラム、またはシステムである(HTA用語集による定義;http://htaglossary.net/health+technology)。
The new definition of health technology assessment: A milestone in international collaboration のBox1の仮訳
注2:このプロセスは、正式かつ体系的で透明性が高く、入手可能な最良のエビデンスを検討するために最先端の手法を用いる。
注3:医療技術の価値の次元は、既存の代替品と比較して、医療技術を使用することによる意図的および非意図的な結果を検討することによって評価することができる。これらの次元には、臨床効果、安全性、コストと経済的影響、倫理的、社会的、文化的、法的問題、組織と環境の側面、さらに患者、親族、介護者、および集団に対するより広い影響もしばしば含まれる。全体的な価値は、とらえる視点、関係する利害関係者、意思決定の状況によって異なる可能性がある。
注4:HTAは、医療技術のライフサイクルの様々な時点、すなわち、市場投入前、市場承認中、市場投入後、医療技術の廃棄に至るまで適用できる。
どんな変化があるのか?
- 我々は、医療技術のライフサイクルにおいて、エビデンスがまだ成熟しておらず、未発表であることが多い時期に、より早く情報を提供し、意思決定することを求められている。このことを認識し、我々はデータを機密扱いで受け入れ、公開文書からはデータを削除してきた。我々は今こそ、機密情報に対する考え方を変えるべき時だと考えている。
- 2023年4月以降に開始される評価については、NICEの技術評価とCADTHは、我々がガイダンスを公表する際に、公表を待っている臨床データを日常的に編集(削除)することはない。ICERは、正式に公開が予定されているデータについては、12ヶ月間、機密事項としてアカデミックに編集することを許可している。
- その他の臨床データについては、ガイダンスの作成に役立つ場合、データの公開が望まれるカテゴリのリストを定義した(付録Aを参照)。新たな課題が発生した場合には、このリストを見直し、更新する予定である。
- 我々の機関が活動する様々な状況を踏まえ、公表予定のない臨床データの管理について、我々は独自の方針を持つことになる。
- 価格や償還条件に関する情報など、商業的に機密性の高いデータの編集には引き続き応じる予定である。
- 特に、医療サービスを利用する人々から直接入手した臨床データに関する場合、透明性の原則を尊重することを保証することは、エビデンスホルダーの責任であると考えている。
なぜ、このような変更をするのか?
- これらの変更には、4つの大きな理由がある:
- a) 透明性は、健康におけるエビデンスに基づく意思決定に対する国民の信頼に不可欠であり、医療技術評価の基礎となるものである。医療技術評価や規制に関わる他の機関は、透明性の向上を求めている(欧州医薬品庁の臨床データ公開に関するページ、医療技術評価に関するEU規則2021/2282、カナダ政府の臨床情報の公開に関するガイダンスを参照)。
- b) 評価の一環としての臨床エビデンスの公開が医学雑誌への掲載を阻害すると考えるのは、もはや適切ではない。この文脈で、国際医学雑誌編集者委員会(ICMJE)は、『医療技術評価機関、医療規制機関、医療機器規制機関、その他の規制機関が公表する評価報告書に含まれる結果やデータを重複した公表とはみなさない(ICMJE annotated recommendations for the conduct, reporting, editing and publication of scholarly work in medical journal)』と指摘している。
- c) 我々は、医療技術評価プロセスが合理的かつ効率的であることを望み、ユーザーにとって重要な活動に資源を使うことができるようにする。
- d) 我々は、我々と一緒に働く人々や一般市民が、我々にこれまでとは異なる働き方を期待していることを受け入れ、彼らに同意する(BMJ Open:Audit of data redaction practices in NICE technology appraisals from 1999 to 2019を参照)。
付録A:臨床データの編集状況
CADTH、ICER、NICEは、編集可能な臨床データのカテゴリーについて共有リストに合意した。
各機関が活動する異なる状況を尊重し、各自のポリシーでこのリストを個別に実施する自由を有する。
- CADTHにおいて、編集可能とは、CADTHが公的に掲載するすべての文書において、機密情報が削除されることを意味する。編集は一定期間経過後も有効ではないが、編集された情報が一般に公開された場合、CADTHは過去に投稿されたレビューレポートを更新することを選択することができる。
- ICERにおいて、編集可能とは、データがacademic-in-confidenceとしてマークされ、12ヶ月間またはデータが一般に入手可能になったときのいずれか早いほうの期間、編集されることを意味する。
- NICEにおいて、編集可能とは、NICEが一般に公開するすべての文書において、機密情報が削除されることを意味する。編集は、一定期間経過後も失効することはない。
表1:臨床データのカテゴリーと編集状況の共有リスト
| 項目 | 編集可能 | 理由 |
| 研究の実施または研究からのデータの分析に使用される方法 | いいえ | メソッドの情報は、インプットがどのように導き出されるかを理解するために必要であり、機密とみなされるインプットを前提にしたものではない。 |
| パブリックドメインで公開されている臨床データ | いいえ | 一般に公開されている情報は、機密情報とはみなされない。 |
| パブリックドメイン化されていない臨床データで、以下のいずれかに該当するもの: – ジャーナルへの掲載を待っている、または – 規制当局からパブリックドメインにリリース予定 | NICEとCADTH: いいえ ICER: はい | 後に一般公開される情報の不必要な編集を避けるため。 医療技術評価機関、医療規制機関、医療機器規制機関、その他の規制機関が公表した評価報告書に含まれる結果やデータは重複公表とはみなされないというICMJEの声明に対応する(ICMJEの声明参照)。 一部の臨床データは、規制当局が実施する透明性政策の一環として、強制開示の対象となり、パブリックドメインに置かれる(欧州医薬品庁の臨床データ公開に関するページ、およびカナダ政府の臨床情報の公開に関するガイダンスを参照のこと)。 学会発表待ちのデータで、パブリックドメインでなく、それ以上の公開がないものは、公開予定のない臨床データとして扱う。 |
| 未公開の臨床データで、公開の予定がないもの | はい | データがパブリックドメインでない場合、この情報は編集可能である。 |
| スポンサーの間接比較で、データが公開されておらず、公開される予定もないもの | はい (ICERは適用外) | データがパブリックドメインでない場合、この情報は編集可能である。 |
| リアルワールドエビデンス研究のデータで、公開されていないもの、公開される予定のないもの | はい | データがパブリックドメインでない場合、この情報は編集可能である。 |
| 臨床試験の批判的評価と間接比較 | いいえ | これは機密情報とはみなされず、編集されることはない。 |
| 意見・仮定に基づくデータ | いいえ | これは機密情報とはみなされず、再編集されることはない。 |
| 参考文献 | いいえ | 参照は、インプットと仮定がどこから導かれたかを理解するために必要であり、機密とみなされるインプットを前提にするものではない。 |
図1:編集状況に関する質問フローチャート
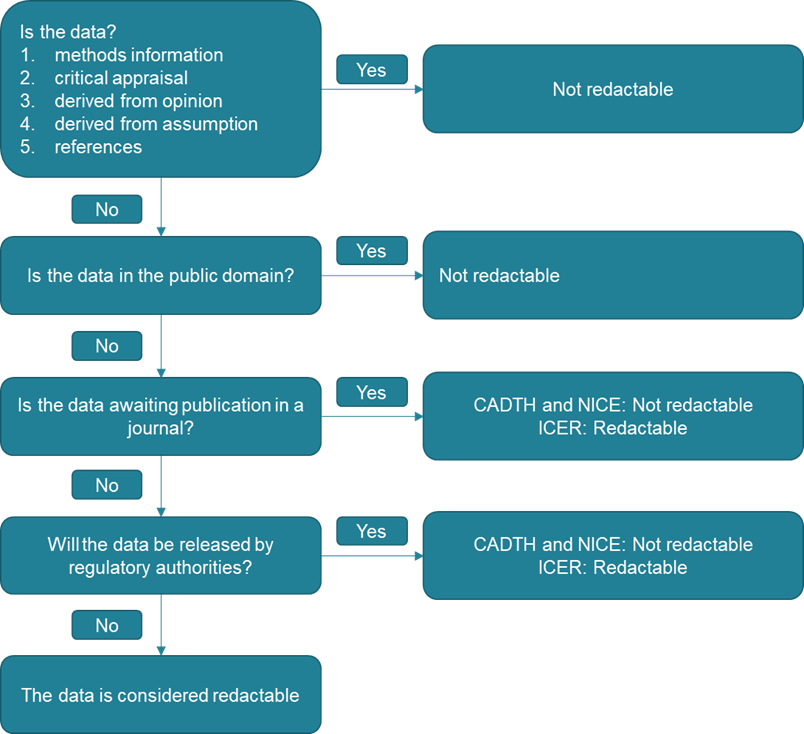
ICERは少しだけ違ったポジションでいる様子ですね。


